Пункционная вертебропластика и лучевая терапия в лечении агрессивных гемангиом позвонков
Мануковский В.А., Жаринов Г.М., Кравцов М.Н., Рудь С.Д., Федоренков А.В.
Российская военно-медицинская академия им. С.М. Кирова, Санкт-Петербург, Россия.
Резюме
До настоящего времени гемангиома позвонка остается не до конца изученной нозологической формой, не определены ни патогенез заболевания, не выработана оптимальная лечебная тактика. И сегодня в большинстве стационаров основным методом лечения агрессивных гемангиом остается лучевая терапия, эффективность которой крайне низка.
Проанализированы данные обследования и результаты лечения 91 (100%) пациента (137 позвонков), находившихся на лечении в клинике нейрохирургии Военно-медицинской академии и отделениях лучевой терапии Российского Научного Центра радиологии и хирургических технологий в период с 1999 г. по 2007 г. по поводу агрессивных гемангиом позвонков. Пункционная вертебропластика выполнена на 40 позвонках, лучевой терапии подвержены 87 позвонков пораженных агрессивными гемангиомами.
ПВП является более эффективным методом лечения агрессивных гемангиом, по сравнению с лучевой терапией. Данный метод способствует уменьшению интенсивности болевого синдрома на 34.4-77.8% от исходного уровня – у 75.7% больных; тогда как локальные боли после курса ЛТ регрессируют на 12.9-28.1% у 43.1% больных.
Определены признаки агрессивности гемангиом, показания к оперативным пособиям, тактика ведения больных. Применение чрескожной вертебропластики в лечении агрессивных гемангиом в короткие сроки позволяет радикально излечить пациента. Операция относится к малоинвазивным, тем самым сокращаются сроки пребывания больных в стационаре и время необходимое для их реабилитации и социальной адаптации.
Ключевые слова: гемангиома позвонка, вертебропластика, костная пластика, лучевая терапия, факторы агрессивности.
Введение. Первое описание гемангиомы тела позвонка относится к 1867 году. R. Virchow представил выявленную на секции сосудистую опухоль, которую и назвал гемангиомой. (Virchow R., 1867). После того, как в практической медицине начали применять лучи Рентгена, появилась возможность прижизненной диагностики гемангиом позвонков. Е. Perman в 1927 году (Perman Е., 1927) впервые изложил рентгенологическую семиотику гемангиом тел позвонков, а спустя три года P. Bailey и Р. Вuсу описали более подробную и детальную рентгенологическую картину заболевания (Bailey P, Bucy P., 1929).
По данным разных авторов, гемангиомы составляют от 4 до 13% (Коновалов А.Н., 2004; Гайдар Б.В., 2002) среди всех опухолей позвоночника и спинного мозга, и до 29% от всех первичных опухолей позвоночника (Ланцман Ю.В., Адамян А.Т., 1986). Независимые морфологические исследования, проводившиеся на большом аутопсийном материале G. Schmorl (1927), D. Topfеr (1928) и Н. Junghanns (1932), показали, что гемангиомы тел позвонков обнаруживаются в 10.7-11.93% случаев во всей популяции.
В современных работах, при описании статистики и распространенности этих образований приводятся ссылки на исследования начала XX века R. Virchow u С. Schmorl. Это связано с тем, что, несмотря на широкое клиническое использование сканирующих методов визуализации, до сих пор не приведено ни одного исследования с помощью КТ и МРТ, посвященного распространенности гемангиом позвонков.
По мнению большинства исследователей гемангиомы чаще встречаются у женщин в постпубертатный период. Соотношение мужчин и женщин по данной нозологии составляет от 1:2 до 1:2.5 соответственно (Белоножко А.Г., 1970, Ланцман Ю.В., Адамян А.Т. 1986, Dorfrnan H.D., Лисовская Р.А., 1964, Dorfman H.D., 1971). Однако, имеются данные свидетельствующие о примерно равном распределении гемангиом в группах различающихся по половому признаку (F. Gray и соавт. 1989).
Гемангиомы позвонков не встречаются у детей, и наибольшее число случаев, приходится на возраст 30-60 лет (Ланцман Ю.В., Адамян А.Т. 1986, Dorfman H.D., 1971, Лисовская Р.А., 1964; Педаченко Е.Г., Кущаев С.В, 2005). По мнению ряда авторов, увеличение числа больных с возрастом объясняется тем, что заболевание очень часто длительное время протекает бессимптомно, проходит много лет, прежде чем оно проявит себя клинически (Ланцман Ю.В., Адамян А.Т. 1986, Лисовская Р.А., 1964). Провоцирующим моментом, который может вызвать активизацию опухолевого процесса, является беременность и травма (Inamasu J., 2006) Согласно данным J. Nguyen и соавт. (1989), 10% всех осложненных гемангиом тел позвонков определяется у беременных женщин.
Гемангиомы локализуются в любом отделе позвоночника, но более часто – в грудном отделе (60-76%), затем в поясничном – (22-29%), крайне редко в шейном – (2-11%) и крестцово-копчиковом (до 1%) отделах (Ланцман Ю.В., Адамян А.Т. 1986, Лисовская Р.А., 1964, Педаченко Е.Г., Кущаев С.В, 2005, Корниенко В.Н., 2006; Nicola N.,1987).
В 66-90% случаев поражается один позвонок (Белоножко А.Г., 1970, Корниенко В.Н., 2006). Множественные гемангиомы встречаются в 10-34% случаев (H. Junghanns 1932, J. Laredo и соавт. 1986, L. Picard и соавт., 1989; В.Н. Корниенко, 2006), что характерно преимущественно для людей пожилого возраста (Клионер И.Л., 1962).
Тело позвонка поражается наиболее часто (до 100%), в 52% – тело и дужки поражаются одновременно, реже в процесс вовлекаются отростки (Ланцман Ю.В., Адамян А.Т. 1986). Изолированное поражение гемангиомой дужки позвонка – редкость, а отростков – не отмечено вовсе (Белоножко А.Г., 1970).
Практически все без исключения авторы выделяют две основные группы гемангиом позвонков:
- «Стабильная», «инертная» или «неагрессивная» гемангиома.
- «Агрессивная» или «активная» гемангиома.
Наиболее многочисленная группа, составляющая более 90% – «неагрессивные» гемангиомы позвонков, характеризующиеся крайне медленным развитием, опухолевые клетки в них не выявляются. Вопрос их местоположения в гистологической классификации до сих пор не ясен. Некоторые ученые относят первую группу к сосудистым мальформациям (Н.И. Краковский, 1974, Соловко А.Ю, 1980, Lee J.P. et al. 1990, Djindjian M., 1992, Dagi T.F., 1990, Raco A.,1990, Зозуля Ю.А., 2002). Однако, трудно предположить, что такого рода порок развития встречается в популяции у каждого 10 человека. Отсутствие гемангиом позвонков у детей и высокая частота их встречаемости у лиц старше 50 лет, указывает на маловероятный генез данных образований – как сосудистых мальформаций. Хотя возможно, что в небольшом проценте случаев природа некоторых гемангиом выявляемых у лиц в возрасте от 18 до 40 лет несет врожденный характер.
G. Schmorl (1927), D. Topfеr (1928) и Н. Junghanns (1932), считают, что большинство гемангиом позвонков – связаны в той или иной степени с дегенеративными процессами в позвоночнике, и именно поэтому превалируют в группе людей пожилого возраста. Они выявили гемангиомы у лиц старше 60 лет в 16%, а в более молодом возрасте – у 3.8%. D. Topfеr (1928) обнаружил гемангиомы в 11.9% всех исследованных позвонков. На возраст до 50 лет приходилось 18.3%, а на возраст старше 50 лет – 81.7% гемангиом. В более современных работах отечественных ученых объективная анатомо-гистологическая картина гемангиом позвонков пожилых людей не имеет бластоматозного характера, который оправдал бы термин «гемангиомы» – как опухоли. Согласно их мнению – это «ангиомоподобные» или телеангиоэктатические изменения, возникшие на фоне остеопороза и адипозной инволюции красного костного мозга, не имеющие клинического значения (Клионер И.Л., 1962, Виноградова Т.П., 1973).
Вторая группа – это истинные опухоли, быстро растущие, распространяющиеся на весь позвонок и за его пределы и вызывающие компрессию нервных структур. Гистологически такая опухоль состоит из зрелых сосудов, между которыми расположена стромальная ткань с редкими явлениями клеточной анаплазии и митозами. Именно термин «гемангиома», должен быть сохранен для обозначения таких образований (Зозуля Ю.А., 2002). Ввиду редкого проявления агрессивности сосудистыми образованиями тел позвонков, гемангиомы данной локализации выявляются нечасто. Встречаемость их составляет от 0.9 до 4% по отношению ко всем гемангиомам позвонков.
Согласно классификациям опухолей костной ткани гемангиомы относят к доброкачественным новообразованиям или к дискутабельной морфологической группе стоящей между опухолью и пороком развития сосудистой ткани.
Таблица N1
Классификация сосудистых спинальных опухолей
(Ю.А. Зозуля, Е.И. Слынько, 2000)
Доброкачественные | Злокачественные |
Гемангиома | Гемангиоперицитома |
Гемангиобластома | Гемангиоэндотелиома |
Ангиолипома | Ангиосаркома |
Ангиофиброма | Неопластический ангиоэндотелиоматоз |
Аневризматическая костная киста |
|
Таблица N2
Частная (детализированная) классификация сосудистых опухолей костей
(Т.П. Виноградова, 1973)
Доброкачественные | Злокачественные |
Ангиома | Ангиосаркома и ее разновидности: |
Гемангиоперицитома | Гемангиоэндотелиома |
Гломангиома | Гемангиоперицитома злокачественная |
| Опухоль Юинга |
| Адамантинома длинных трубчатых костей |
| Прочие ангиопластические злокачественные опухоли |
Гистологически гемангиомы позвонков разделяют на: а) капиллярные; б) кавернозные; в) смешанные.
Таким образом, вопросы патогенеза и патоморфологии гемангиом позвонков до сих пор вызывают бурные споры среди ученых. Неопределенность местоположения гемангиом позвонков в гистологическом ряду во многом объясняется их различным поведением, – от инертных клинических форм до активных опухолей с деструирующим характером роста. Достаточно четкий по своим критериям клинико-рентгенологический диагноз – «гемангиома позвонка» в настоящее время объединяет разные по своей сути образования.
Основными методами диагностики гемангиом позвонков являются: спондилография, компьютерная томография (КТ), магнитно-резонансная томография (МРТ). Спондилография позволяет на догоспитальном этапе выявить признаки поражения тела позвонка гемангиомой (перестройка костной структуры, изменение формы позвонка, сохранность замыкательных пластинок и кортикального слоя).
КТ-признаки гемангиомы:
- симптом «медовых сот» или «польского горошка» вследствие частичного лизиса костных трабекул, частичной гипертрофии сохранившихся костных структур;
- картина продольной исчерченности или симптома «вельвета» на КТ-реконструкциях;
- «вздутие» тела позвонка;
- компрессионная деформация и переломы тела позвонка.
Главным МР-симптомом гемангиомы позвонка является испещренный характер сигнала, гиперинтенсивный в Т2 ВИ и изо- гипоинтенсивный в Т1 ВИ. МРТ позволяет оценить распространенность мягкотанного компонента гемангиомы при его наличии.
До настоящего времени среди клиницистов не существует однозначного мнения об агрессивности гемангиомы. Какие признаки и какое количество их должно быть, что бы считать гемангиому агрессивной?
Сопоставление клинической симптоматики и данных лучевых методов обследования позволило J.D. Laredo, с соавт. выделить критерии агрессивности гемангиом (Laredo J.D., 1986):
- Расположение на уровне Th3–Th9 позвонков (рис. 1);
Рис. 1. МРТ. Агрессивная гемангиома тела ThVIII позвонка.
- Тотальное поражение тела позвонка (рис. 2);
 А
А
 Б
Б
Рис. 2. КТ. Гемангиома занимающая практически весь объем тела ThVII позвонка. (A -аксиальный срез; Б - реконструкция).
- Распространение опухолевого процесса на корень и дужки позвонка (рис. 3);
 Рис. 3. КТ. Агрессивная гемангиома тотально поражающая тело ThXII позвонка с распространением на дугу.
Рис. 3. КТ. Агрессивная гемангиома тотально поражающая тело ThXII позвонка с распространением на дугу.
- Костная экспансия с выпячиванием кортекса с нечеткими краями на рентгенограммах (рис. 4);
Рис. 4. Рентгенограмма. Агрессивная гемангиома ThIV позвонка; костная экспансия с выпячиванием кортекса с нечеткими краями.
- Неравномерная трабекулярная структура гемангиомы (рис. 5);
 Рис. 5. КТ. Неравномерная трабекулярная структура гемангиомы тела ThVII позвонка.
Рис. 5. КТ. Неравномерная трабекулярная структура гемангиомы тела ThVII позвонка.
- Наличие эпидурального или паравертебрального компонентов опухоли (рис. 6);
 А
А
 Б
Б
Рис. 6. МРТ. Эпидуральный компонент гемангиомы LI позвонка с поражением ножки дуги (А),
паравертебральное распространение гемангиомы ThXI позвонка в сочетании с распространением но правую ножку дуги (Б).
- Низкий сигнал на Т1 и высокий – на Т2 ВИ на МРТ, накопление контрастного вещества при проведении КТ с контрастированием (рис. 7).
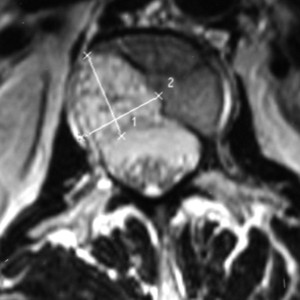
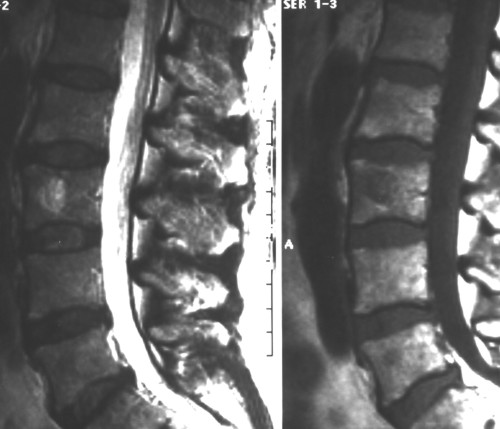 Рис. 7.МРТ. Гиперинтенсивный сигнал в Т2 ВИ и гипоинтенсивный в Т1 ВИ от гемангиомы LIII позвонка.
Рис. 7.МРТ. Гиперинтенсивный сигнал в Т2 ВИ и гипоинтенсивный в Т1 ВИ от гемангиомы LIII позвонка.
Н. Deramond с соавт. (1989) предлагают рассматривать гемангиому как агрессивную при выявлении трех из любых перечисленных признаков.
Педаченко Е.Г. и Кущаев С.В. (2005) сделали попытку выделить группы «абсолютно агрессивных», «абсолютно неагрессивных» гемангиом, и «спорные критерии агрессивности» гемангиом.
I. Абсолютные критерии агрессивности:
- наличие компрессионного перелома тела позвонка;
- компрессия спинного мозга;
- наличие эпидурально расположенного компонента опухоли;
- наличие эпидуральиой гематомы;
- КТ - отсутствие липидов в интра-трабекулярном пространстве, наличие мягкотканной солидной части опухоли;
- МРТ - низкая интенсивность сигнала от опухоли на Т1 ВИ при высокой интенсивности на Т2 ВИ;
- MP-спектроскопия низкое содержание липидов.
II. Абсолютные критерии неагрессивной гемангиомы:
- КТ - наличие жировой ткани в межтратрабскулярном пространстве;
- отсутствие мягкотканной солидной части опухоли;
- МРТ - высокая интенсивность сигнала от опухоли на Т1 и Т2 ВИ;
- МР-спсктроскопия - высокое содержание липидов.
III. Спорные признаки агрессивности гемангиом:
- расположение гемангиомы на грудном уровне.
В данной классификации не указан признак «крупной гемангиомы», поражающей большую часть тела позвонка. Хотя многие исследователи считают, что размеры гемангиомы, составляющие более 60% объема тела позвонка, создают угрозу для развития компрессионного перелома (Laredo J.D., 1986; Deramond Н.с соавт., 1989). Непонятным остается критерий увеличения гемангиомы в динамике. Какие гемангиомы требуют динамического наблюдения, и при достижении каких размеров опухоли необходимы активные действия врача? Влияют ли на этот выбор другие признаки? К предложенным критериям не дается каких-либо пояснений в отношении выбора по ним показаний к лечению.
До настоящего времени лечебная тактика при агрессивных гемангиомах позвонков не определена. Основным методом лечения до недавнего времени была лучевая терапия, целесообразность применения которой сегодня оспаривается ввиду большой лучевой нагрузки необходимой для достижения анталгического эффекта (D. Rades и соавт., 2003). Существует мнение, что если лучевая терапия и дает в отдельных случаях улучшение, то при этом не меняет рентгенологическую картину гемангиомы, и не гарантирует от рецидивов. (Алборов Г.К., 1970г.).
Пункционная вертебропластика (ПВП), по данным многих исследователей, обладает исключительной эффективностью при лечении больных с этой патологией. Впервые пункционное введение костного цемента в пораженное тело позвонка провели в 1984 г. P. Galibert и Н. Deramond. Опыт первых операций показал, что заполнение гемангиомы костным цементом прекращает рост опухоли, обеспечивает восстановление опороспособности пораженного позвонка, устраняет болевой синдром.
Несмотря на достаточно длительное применение метода вертебропластики, не проведено ни одного крупномасштабного рандомизированного исследования эффективности ее при агрессивных гемангиомах позвонков. Мировой опыт по данному разделу базируется на многочисленных наблюдениях, включающих от 3-х до 50 случаев применения ПВП при данной патологии.
Сегодня отсутствуют общепринятые показания и противопоказания к проведению ПВП при гемангиомах позвонков. Основными показаниями являются клинические и рентгенологические признаки агрессивности. Какие именно признаки «активности» гемангиом считать основными, и какие при этом должны быть размеры новообразования – до сих пор не определено.
Цель исследования: оценить эффективность пункционной вертебропластики и лучевой терапии в лечении агрессивных гемангиом позвонков (АГП).
Материалы и методы исследвания.
Проанализированы данные обследования и результаты лечения 91 (100%) пациента (137 позвонков), находившихся на лечении в клинике нейрохирургии Военно-медицинской академии и отделениях лучевой терапии Российского Научного Центра радиологии и хирургических технологий период с 1999 г. по 2007 г. по поводу агрессивных гемангиом позвонков. Мужчин было 23 (25.3%) (25 позвонков), женщин – 68 (74.7%) (112 позвонков). Средний возраст больных составил 52.7 года и колебался в пределах от 19 до 81 года. В основную группу вошли пациенты, получавшие хирургическое лечение – 33 человека (36.3%; 43 пораженных позвонка) (группа I). Контрольную группу составили больные прошедшие лучевую терапию – 58 человек (63.7%; 94 пораженных позвонка) (группа II). Пункционная вертебропластика (ПВП) выполнена на 40 позвонках, лучевой терапии подвержены 87 позвонков пораженных агрессивными гемангиомами. У всех поступивших в стационар пациентов на амбулаторном этапе был установлен диагноз – агрессивная гемангиома.
В I группе 26 (60.4%) агрессивных гемангиом локализовались в грудном, 14 в поясничном (32.5%) и 3 (6.9%) в шейном отделе позвоночника. Во II группе данное соотношение составило: 43 (45.7%), 48 (51.1%) и 3 (3.2%) соответственно. Множественные гемангиомы выявлены у 7 (21.2%) больных в основной группе и у 13 (22.4%) человек в контрольной группе. Пациенты с тремя и более гемангиомами были женщины, средний возраст которых составил 57.4 лет.
Все больные на этапе подготовки к лечению были обследованы по стандартной схеме, которая включала: общий и неврологический осмотры, общеклиническое лабораторное исследование, рентгенологическое (в том числе КТ) и МРТ обследование, в некоторых случаях обследование дополнялось специальными методиками. На основании данных обследования устанавливали локализацию процесса, его распространенность, степень клинических проявлений, выраженность сопутствующих заболеваний. Верификация диагноза АГП, как правило, основывалась на выявлении у больных следующих основных синдромов: локального болевого синдрома, рентгенологического и МР-синдрома.
Степень выраженности болей, двигательные нарушения, связанные с мышечно-тоническими рефлекторными реакциями, и действенность аналгетических средств оценивались по шкале качества жизни, разработанной J.R. Gaughen и соавт. (2000) (Таблица N3) а также по Оригинальной шкале качества жизни пациента, разработанной в клинике нейрохирургии ВМедА (Таблица N4).
Таблица N3
Шкала оценки качества жизни пациента по J.R. Gaughen и соавт. (2000)
Критерии | Баллы |
Выраженность болевого синдрома | |
самая интенсивная боль | 10 |
Двигательная активность | |
хождение с посторонней помощью | 1 |
передвижение на коляске | 2 |
ограничение сидения в постели | 3 |
ограничение подвижности в постели | 4 |
Зависимость от анальгетиков | |
периодический прием | 1 |
регулярный прием ненаркотических анальгетиков | 2 |
периодический прием пероральных наркотических препаратов | 3 |
регулярный прием пероральных наркотических препаратов | 4 |
регулярный прием парентеральных наркотических препаратов | 5 |
Таблица N4
Оригинальная шкала качества жизни пациента (ОШКЖ)
(В.А. Мануковский, М.Н. Кравцов)
Критерии | Баллы |
Выраженность локального болевого синдрома | |
незначительная боль постоянного характера | 1 |
периодическая боль средней интенсивности | 2 |
боль средней интенсивности постоянного характера | 3 |
периодическая интенсивная боль | 4 |
интенсивная боль постоянного характера | 5 |
Двигательная активность | |
возможность поддержания вертикального положения в течение дня; легкие ограничения объема движений позвоночника | 1 |
возможность поддержания вертикального положения в течение дня с периодическим отдыхом (в горизонтальном положении); ограничен объем движений позвоночника | 2 |
значительное ограничение физической активности в вертикальном положении, и объема движений позвоночника | 3 |
невозможность поддержания вертикального положения без посторонней помощи и вспомогательных предметов (трость, костыли) | 4 |
вынужденное положение (сидя, лежа) | 5 |
Зависимость от анальгетиков | |
периодический прием | 1 |
регулярный прием ненаркотических анальгетиков | 2 |
периодический прием пероральных наркотических препаратов | 3 |
регулярный прием пероральных наркотических препаратов | 4 |
регулярный прием парентеральных наркотических препаратов | 5 |
КТ исследование выполнялось на спиральной установке IV поколения “Somatom Plus – 4 А” (Siemens, Германия) с матрицей 1024´1024 элементов изображения и охватило 32 (96.7%) больных. МРТ проведено 33 (100%) пациентам на установке “Magnetom 63SP” (Siemens) с величиной индукции магнитного поля 1.5 Тл.
На основании полученных данных при КТ и МРТ оценивали выраженность всех известных критериев агрессивности гемангиомы позвонка, описанных в литературных источниках. Показание к лечению выносились на основе балльной шкалы выраженности клинических и рентгенологических симптомов агрессивности, разработанной в клинике нейрохирургии ВМедА. Учитывалась также классификация Н. Deramond, A. Cotten, С. Depriеster (2002).
58 пациентам (94 позвонка), вошедшим в контрольную группу, дистанционная лучевая терапия (ДЛТ) проведена на отечественных (ЛУЭВ-15 М1) и импортных (SL-20 и SL-75-5, фирмы «Philips») линейных ускорителях электронов с граничной энергией тормозного излучения от 6 до 18 МЭВ (рис. 8).
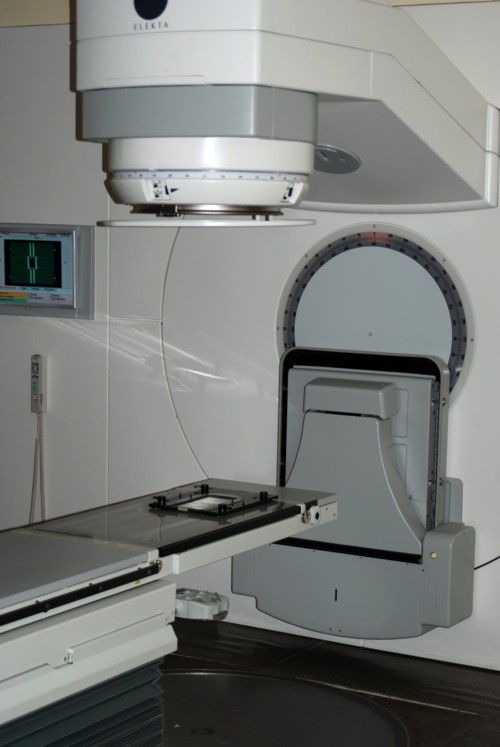
Рис. 8. Линейный ускоритель электронов SL-20 (фирма «Philips»).
Предлучевая подготовка осуществлялась с помощью симулятора фирмы «Philips», КТ (либо МРТ), рентгено-диагностической аппаратуры, адаптированной к условиям предлучевой подготовки, а оптимальное дозиметрическое планирование проводилось на компьютерной планирующей станции с учетом гетерогенности тканей и кривизны поверхности тела.
Использовались следующие системы дозиметрического планирования:
- «КОСПО – 2d-planning» (компьютерная система планирования облучения, Россия) на базе комьютера Pentium I и дигитайзера Wintime KD 5000.
- «ROCS – 2.5d-planning» (Radiation Oncology Computer Systems, USA) version 5.1.6 на базе компьютера Pentium I и дигитайзера Numonics.
ДЛТ для больных с локализацией гемангиом в шейном отделе позвоночника (3 позвонка, 3.4%) осуществлялась в статическом режиме с одно- или двух тангенциальных полей. Для пациентов с локализацией гемангиом в грудном (42 позвонка, 48.3%) и поясничном отделах позвоночника (42 позвонков, 48.3%) ДЛТ проводилась как в подвижном, так и в статическом режимах. Условия облучения выбирались таким образом, чтобы зоны интереса охватывались 80-90% изодозным распределением (рис. 9).
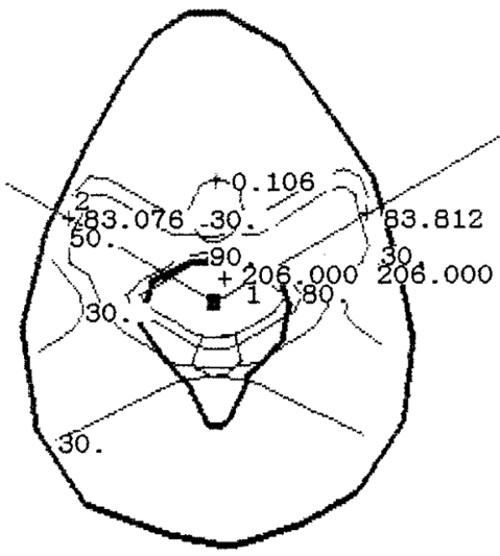
Рис. 9. Изодозное распределение при локальном облучении тела СVI позвонка в статическом режиме
через два противолежащих поля на линейном ускорителе электронов тормозным излучением с граничной энергией 6МэВ.
Облучение проводилось в режиме обычного фракционирования в РОД 2Гр ежедневно, 5 раз в неделю, СОД доводилась до 30Гр. При множественных поражениях позвоночника (13 пациентов, 22.4%) отдавалось предпочтение статическому облучению с двух или трех полей. СОД составляла от 30 до 38Гр.
Пункционная вертебропластика выполнена 33 пациентам (40 позвонков). В шести случаях ПВП выполнялась на нескольких уровнях (у 1 пациента – на 3-х, у 5 пациентов – на 2-х уровнях). В пяти случаях многоуровневая ПВП была выполнена за одного оперативное вмешательство. У больного с тремя агрессивными гемангиомами операция проведена за два этапа. В двух случаях ПВП проводилась в комбинации с открытой операцией – удалением эпидурального мягкотканого компонента опухоли, стабилизацией позвоночника.
Положение больного на операционном столе, интраоперационная разметка не имели отличительных особенностей от таковых при выполнении пункционной вертебропластики по поводу других заболеваний позвоночника.
При выполнении ПВП на грудном и поясничном отделах позвоночника, в большинстве случаях, использовалась внутривенная анестезия в сочетании с местным введением анестетиков. Пункционная вертебропластика на уровне шейного отдела позвоночника выполнялась под общей анестезией с интубацией трахеи.
Были использованы несколько видов пункционных игл, фирм «Stryker» и «Cook» (США). Иглы отличались по форме концевой дистальной части: скошенные (45°, 75°) и конусообразные четырехгранные (пирамидные). У игл со скошенным дистальным концом на рукоятке имелось специальное обозначение направления среза (рис.10). Наружный диаметр игл составлял от 13G (2.41мм.) и 11G (3.05мм.). Длина варьировала от 10см. до 15см. Размеры и виды игл подбирались в зависимости от уровня пунктируемого позвонка, особенностей его анатомического строения, размеров и локализации гемангиомы.
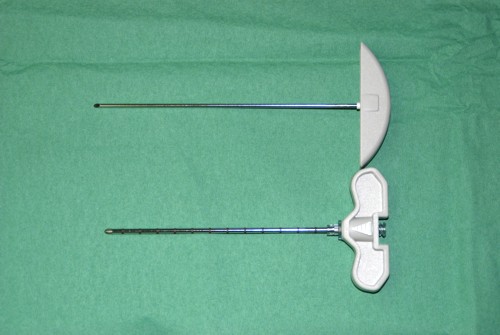 Рис. 10. Игла и мандрен со скошенным дистальным концом для пункции тела позвонка.
Рис. 10. Игла и мандрен со скошенным дистальным концом для пункции тела позвонка.
Использовали наиболее распространенный способ навигации при выполнении вертебропластики – флюороскопию (на многофункциональном рентгеновском аппарате «Polystar T.O.P.» (Siemens, Германия) и «Angiostar Plus» (Siemens, Германия) (рис.11). В одном случае операция выполнялась под контролем спирального компьютерного томографа «SOMATOM PLUS – 4 А» (Siemens, Германия).
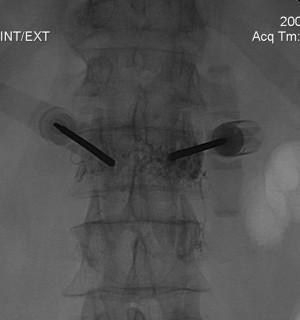
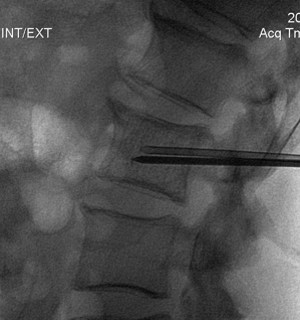
Рис. 11. Выполнение пункционной вертебропластики под контролем флюороскопии.
Полученные данные анализировали на рабочей станции под управлением программы «ACOM.PC», а так же на специализированной рабочей станции с построением двух- и трехмерных реконструкций. Возможности рентгеновской установки позволяли получать цифровое изображение на экране монитора во время операции как в фиксированном виде, так и в режиме электронно-оптического преобразования.
Интраоперационная веноспондилография выполнялась в 100% случаев при ПВП по поводу агрессивных гемангиом. Методика проводилась посредством присоединения к пункционной игле шприца системы «Luer-Lock» с контрастирующим веществом.
В качестве контрастного вещества использовали неионные препараты (Омнипак, Ультравист). Расход контрастирующего вещества на исследование зависел от объема тел позвонков. В шейном отделе позвоночника объем вводимого контраста составлял 3-4 мл, в грудном 6-8 мл, в поясничном 6-10 мл. с каждой стороны. Дозирование контрастирующих веществ соответствовало рекомендациям фирм-производителей.
Продолжение »